Лечение детей антиретровирусными препаратами становится все более сложным. Чтобы лечение было
успешным, требуется сотрудничество различных специалистов и членов семьи ребенка.
Антиретровирусная терапия не бывает успешной без хорошего соблюдения назначений. В проспективном исследовании PACTG 377 критерием соблюдения назначений было отсутствие пропусков в приеме
препаратов за последние 3 дня. При использовании этого критерия, соблюдали назначения только 70%
детей (125 детей за 48 недель наблюдения; Van Dyke, 2002). Эти данные показывают, что постоянное мотивирование детей и ухаживающих за ними взрослых имеет очень большое значение. Расписание ежедневного приема препаратов нужно подробно обсудить с ухаживающими за ребенком взрослыми и согласовать его с распорядком дня и недели. Необходимо установить четкие цели лечения, например, прием 90% предписанных доз. Необходимо обучать пациента и членов семьи по вопросам, связанным с АРВ
препаратами. У подростков добиться соблюдения назначения бывает особенно сложно. В этом возрасте
за соблюдением назначений нужно следить особенно тщательно, привлекать психологов и социальных
работников. В некоторых случаях для обучения приему препаратов и оценки переносимости лечения помогает короткая госпитализация в начале АРТ.
Для оценки соблюдения назначений можно использовать фармакологический мониторинг. Определение
уровней препаратов в крови помогает также оценить эффективность АРВ препаратов, их индивидуальную фармакокинетику и риск токсичности.
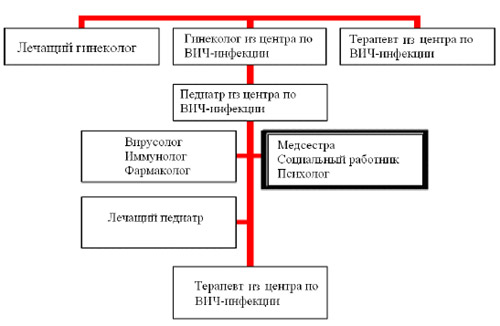
Рисунок 2. Многопрофильный подход к оказанию помощи ВИЧ-инфицированным детям и их семьям.
Данных о фармакокинетике АРВ препаратов у детей очень мало, поэтому рекомендуется включать детей
в текущее исследование PENTA14 (http://www.pentatrials.org). Измерение концентраций препаратов в
плазме помогает скорректировать дозы и предотвратить занижение концентрации и токсичность.
Наблюдение за детьми, получающими АРТ обязательно должно включать регулярные физикальное и лабораторные исследования. Ведением таких детей должны заниматься врачи, имеющие опыт лечения
ВИЧ-инфекции у детей и проведения АРТ. Прежде чем начинать или менять АРТ нужно получить результаты исследования не менее двух отдельно взятых проб крови. Вирусная нагрузка и число лимфоцитов CD4 могут меняться из-за инфекций и вакцинации. Поэтому не рекомендуется принимать решения
на основе данных, полученных в течение 14 сут после инфекции или вакцинации.
Существующими средствами добиться излечения ВИЧ-инфекции пока нельзя. У некоторых детей вирусная нагрузка остается ниже измеримого уровня в течение нескольких лет, и специфические антитела к
ВИЧ у них не определяются. Однако даже у них ВИЧ можно обнаружить с помощью ультрачувствительного анализа (Persaud, 2004). Поэтому риск и пользу АРТ необходимо соотносить у каждого ребенка индивидуально. АРТ с перерывами в лечении или плохим соблюдением назначений может принести больше вреда, чем пользы. Решение о начале терапии имеет для ребенка и его семьи кардинальное значение.
Обычно это означает, что ребенок должен будет принимать АРВ препараты всю жизнь. Плановые перерывы в лечении у детей и подростков в контролируемых испытаниях не изучались. Ретроспективный
анализ неплановых перерывов в лечении у детей показал значительное снижение доли лимфоцитов CD4
на 6,6% в год (Gibb, 2004). Изучение плановых перерывов в лечении ВИЧ-инфекции у детей в зависимости от числа лимфоцитов CD4 сегодня проводится в рамках исследования PENTA (Pediatric European
Network for Treatment of AIDS) (PENTA11).
В табл. 5 показаны схемы АРТ, рекомендуемые для детей. В американском исследовании PACTG 338, в
которое вошли 297 детей, было показано, что схемы, содержащие ИП, эффективнее, чем двухкомпонентные схемы, содержащие 2 НИОТ. Кажется целесообразным начинать лечение со схем, содержащих
две группы препаратов (2 НИОТ + ИП или 2 НИОТ + ННИОТ), чтобы сохранить одну или две группы
препаратов для будущих замен АРТ. Если при лечении не будет достигнуто полное подавление вируса,
высока вероятность перекрестной устойчивости к ННИОТ и ИП. Поэтому сохранение резервной группы
препаратов может быть полезным для долгосрочной эффективности лечения. Однако в недавнем исследовании PACTG 256 активная тактика с использованием 3 групп препаратов (НИОТ + ННИОТ + ИП)
привела к высокоэффективному и длительному снижению вирусной нагрузки (у 72% больных в течение
более 4 лет), особенно у детей, у которых лечение было начато рано (
Таблица 5. Рекомендуемые схемы АРТ для детей
| Схемы | Рекомендации |
| НИОТ* 1 + НИОТ 2 + ИП** или НИОТ 1 + НИОТ 2 + ННИОТ *** | Включить ребенка в кооперированное клиническое испытание (например PENPACT 1) |
* = Нуклеозидный ингибитор обратной транскриптазы (зидовудин, диданозин, ламивудин, ставудин, абакавир, эмтрицитабин, тенофовир).
** = Ингибитор протеазы (нелфинавир, лопинавир/ритонавир, атазанавир, индинавир, ампренавир. Ритонавир в качестве усилителя).
*** = Ненуклеозидный ингибитор обратной транскриптазы (невирапин, эфавиренз).
В плацебо контролируемом американском исследовании CNAA3006, в которое вошли дети, получавшие
ранее АРВ препараты, трехкомпонентная терапия НИОТ была более эффективной, чем лечение двумя
НИОТ (Saez-Llorens, 2001). Однако то, что дети ранее уже получали АРТ, является важной оговоркой. У
взрослых комбинации трех НИОТ менее эффективны, чем комбинация НИОТ с ИП или ННИОТ. В настоящее время данных об использовании трех НИОТ в качестве начальной схемы лечения у детей нет.
Ниже описаны различные группы АРВ препаратов, которые сегодня используются в педиатрии, особенности их применения у детей, дозы и побочные эффекты. Все препараты могут вызвать тошноту, рвоту, лихорадку, головную боль, понос, сыпь и потерю аппетита.
Для лечения ВИЧ-инфекции у детей НИОТ используются уже больше 15 лет. Комбинация 2 НИОТ в составе ВААРТ эффективна и хорошо переносится. Тяжелые побочные эффекты встречаются редко, но могут угрожать жизни, например лактацидоз и жировая дистрофия печени. Другие побочные эффекты —
нейромышечная дисфункция, кардиомиопатия, панцитопения, панкреатит и нейропатия. По-видимому,
все эти побочные эффекты обусловлены митохондриальной токсичностью НИОТ. Из-за фармакологического и противовирусного антагонизма, а также взаимного усиления нейротоксичности следующие комбинации не рекомендуются: зидовудин + ставудин, диданозин + ставудин (не для первой линии), зальцитабин + диданозин, ставудин + зальцитабин и ламивудин + зальцитабин. Менее токсичны для митохондрий следующие НИОТ: ламивудин, абакавир, эмтрицитабин и тенофовир.
Зидовудин (Ретровир™) выпускается в виде сиропа, капсул, таблеток и концентрата для инъекций или
в/в введения. Доза составляет 180 мг/м2 внутрь каждые 12 ч. Максимальная доза — 300 мг каждые 12 ч.
Ламивудин (Эпивир™) выпускается в форме раствора для приема внутрь и таблеток. Доза составляет 4
мг/кг каждые 12 ч, максимальная доза 150 мг каждые 12 ч. Для старших детей и подростков (масса тела
более 35 кг) можно назначать комбинацию с зидовудином (Комбивир™) и благодаря этому сократить
число таблеток, которое необходимо принимать в сутки. У взрослых ламивудин показал противовирусную активность против вируса гепатита B. Поэтому у детей с хроническим гепатитом B важно включать
этот препарат в схему ВААРТ. Схема с абакавиром для однократного приема в сутки не уступает в эффективности схемам с двукратным приемом в сутки (исследование PENTA 13).
Ставудин (Зерит™) выпускается в виде раствора для приема внутрь и в капсулах. Доза составляет 1
мг/кг каждые 12 ч. Максимальная доза — 40 мг каждые 12 ч. Ставудин не рекомендуется для схем первого ряда из-за высокого риска липоатрофии (см. ниже).
Диданозин (Видекс™) выпускается в виде раствора для приема внутрь и в таблетках. Доза составляет
200 мг/м2 1 раз в сутки. Максимальная доза 400 мг (при массе тела ? 60 кг) или 250 мг (при массе тела
Абакавир (Зиаген™) выпускается в виде раствора для приема внутрь и в таблетках. Доза составляет 8
мг/кг каждые 12 ч, максимальная доза — 300 мг 2 раза в сутки или 600 мг 1 раз в сутки. В исследовании
PENTA 5 схемы с абакавиром были более эффективны в снижении вирусной нагрузки, чем схемы с зидовудином и ламивудином. Абакавир может вызвать смертельную реакцию гиперчувствительности. При
гиперчувствительности препарат отменяют и в дальнейшем лечение им не возобновляют, так как у
взрослых описаны случаи смертельного исхода при повторном назначении абакавира.
Эмтрицитабин (Эмтрива™) выпускается в капсулах. В I фазе испытаний доза составила 6 мг/кг (Wang,
2004). При приеме препарата в капсулах уровень препарата в плазме повышается на 20%. Препарат нужно принимать 1 раз в сутки. Максимальная доза — 200 мг 1 раз в сутки.
Тенофовир (Вирид™) выпускается только в таблетках. У 18 детей и подростков от 6 до 16 лет доза 200
мг/м2 1 раз в сутки переносилась хорошо (Hazra, 2004). Контролируемых исследований эффективности
тенофовира у детей не проводилось.
У ННИОТ низкий генетический барьер развития лекарственной устойчивости. При недостаточной дозе
или плохом соблюдении назначений мутации перекрестной устойчивости ко всем существующим ННИОТ появляются уже через несколько недель. ННИОТ выпускаются в жидких лекарственных формах,
приятных на вкус, которые лучше переносятся детьми, чем жидкие препараты ИП.
Эфавиренз (Сустива™) выпускается в капсулах и в виде раствора для приема внутрь. Доза при массе тела 10-15 кг составляет 200 мг, 15-20 кг — 250 мг, 20-25 кг — 300 мг, 25-33 кг — 350 мг, 33-40 кг —
400 мг, > 40 кг — 600 мг 1 раз в сутки. Максимальная доза — 600 мг 1 раз в сутки. Доза раствора для
приема внутрь должна быть на 20% выше дозы в капсулах. Нарушения со стороны ЦНС (сонливость,
бессонница, тревожные сновидения, спутанность сознания, нарушения мышления и концентрации внимания, амнезия, возбуждение, деперсонализация, галлюцинации, эйфория) у детей встречаются реже,
чем у взрослых. Сыпь наблюдается менее чем у 10% пациентов, редко бывает тяжелой и обычно проходит в течение нескольких дней несмотря на продолжение приема препарата.
Невирапин (Вирамун™) выпускается в таблетках и в виде суспензии. Доза 150 мг/м2 каждые 12 ч 1 раз в
сутки в течение 14 сут, затем 150 мг/м2 каждые 12 ч, при условии, что показатели функции печени в
норме. В рестроспективном анализе однократный прием препарата в дозе 300 мг/м2 начиная с третьей
недели лечения был столь же эффективен, как и двукратный прием (Verweel, 2003). Самый частый побочный эффект невирапина — сыпь. Она появляется почти у 16% детей на первой неделе лечения, и в
8% случаях бывает очень тяжелой и требует госпитализации. В редких случаях развиваются угрожающие жизни осложнения (синдром Стивенса-Джонсона, синдром Лайелла). Невирапин может вызвать поражение печени, у взрослых описаны смертельные случаи, но у детей гепатотоксичность встречается реже.
Все ингибиторы протеазы можно использовать в комбинации с двумя НИОТ. ИП отличаются между собой по переносимости и побочным эффектам. Как и у взрослых при лечении ИП возможна дислипопротеидемия (Lainka, 2002). Она проявляется повышением уровня общего холестерина, триглицеридов и холестерина ЛПНП и снижением уровня холестерина ЛПВП. При липодистрофии снижается количество
подкожного жира (липоатрофия) или увеличивается отложения подкожного и висцерального жира (липогипертрофия), в том числе отложение жира в надлопаточной области (жировой горбик) и увеличение
соотношения окружности талии и окружности бедер. Липоатрофия проявляется уменьшением жировой
ткани на лице, ягодицах и конечностях, при этом становятся очень заметны периферические вены.
Обычно телосложение меняется постепенно, в течение нескольких месяцев или лет. Точная частота липодистрофии у детей не известна, и четкие диагностические критерии отсутствуют. Липодистрофия и
дислипопротеидемия сопутствуют друг другу, их патогенетическая взаимосвязь не ясна. В патогенезе
липодистрофии могут играть роль и препараты других групп, в частности НИОТ (например ставудин) и
ННИОТ (эфавиренз, но не невирапин). К побочным эффектам ИП относится также инсулинорезистентность, которая может проявляться гипергликемией натощак, с развитием сахарного диабета или декомпенсацией предшествующего сахарного диабета. Кроме того, ИП могут снижать минеральную плотность
костей и влиять на их метаболизм (Mora, 2004). Отдаленные последствия побочных эффектов АРТ с использованием ИП для физического развития ребенка не известны.
Лопинавир/ритонавир (Калетра™) — это комбинированный препарат, содержащий лопинавир и, в качестве фармакокинетического усилителя, ритонавир. Препарат выпускается в капсулах и в виде раствора
для приема внутрь. Независимо от того, получал ребенок АРТ раньше или нет, комбинация лопинавира с
ритонавиром в сочетании с НИОТ или ННИОТ показала высокую эффективность (Saez-Llorens, 2003;
Fraaij, 2004). Доза при массе тела 7-15 кг составляет 13 мг/кг лопинавира + 3,25 мг/кг ритонавира 2 раза в
сутки, при массе 15-50 кг — 11 мг и 2,75 мг соответственно, а при массе тела > 50 кг — 533 мг и 133 мг
соответственно. В сочетании с ННИОТ может потребоваться повышение дозы до 30%, в этом случае бывает полезен мониторинг сывороточной концентрации препарата.
Нелфинавир (Вирасепт™) выпускается в таблетках. Большинством детей он хорошо переносится. Доза
составляет 55 мг/кг каждые 12 ч у детей первых 3 мес жизни и 75 мг/кг каждые 12 ч у детей старше 3
мес. Максимальная доза составляет 1250 мг каждые 12 ч. Некоторым детям старшего возраста требуется
доза 1500 мг каждые 12 ч, что превышает дозу для взрослых. Полезен мониторинг сывороточной концентрации препарата. В исследовании PENTA7 у детей первых 3 мес жизни комбинация нелфинавира со
ставудином и диданозином плохо всасывалась, концентрация препаратов в плазме и подавление вирусной нагрузки были недостаточными (Aboulker, 2004). Самый частый побочный эффект — диарея, но отменять из-за нее препарат требуется редко. Для облегчения приема нелфинавира таблетки можно крошить и растворять в воде. В исследовании PENTA5 порошок нелфинавира переносился плохо.
Ампренавир (Агенераза™) детям до 4 лет не рекомендуется. Препарат выпускается в капсулах и в виде
раствора для приема внутрь. Доза составляет 20 мг/кг каждые 12 ч, для раствора для приема внутрь —
22,5 мг/кг каждые 12 ч. Максимальная доза составляет 1200 мг каждые 12 ч. В комбинации с ННИОТ до-
зу ампренавира нужно увеличить на 30%. У 5 детей, ранее получавших интенсивную АРТ, ампренавир в
сочетании с делавирдином показал хорошую эффективность (Engelhorn, 2004). Самые частые побочные
эффекты — тошнота, рвота, диарея, головная боль. У взрослых сегодня используется препарат — пред-
шественник ампренавира — фосампренавир, в дозе 1400 мг 2 раза в сутки (без ритонавира) или в дозе
1400 мг + ритонавир 200 мг 1 раз в сутки. Доза для детей не одобрена, для лечения ВИЧ-инфекции у детей препарат проходит испытания.
Ритонавир (Норвир™) выпускается в виде раствора для приема внутрь и в капсулах. Однако большинство детей не переносят вкус раствора. Доза составляет 350-400 мг/м? каждые 12 ч, максимальная доза —
600 мг каждые 12 ч. Сегодня ритонавир применяется почти исключительно для усиления других ингибиторов протеазы, для чего используется в дозе 75 мг/м2 каждые 12 ч.
Индинавир (Криксиван™) выпускается в капсулах. Доза составляет 500 мг/м? каждые 12 ч в комбинации с ритонавиром 75 мг/м? каждые 12 ч. Побочные эффекты включают нефролитиаз, особенно при высокой концентрации препарата в крови.
Саквинавир (Инвираза™ твердые желатиновые капсулы или Фортоваза™ мягкие желатиновые капсулы). Доза для детей не установлена. Есть небольшой опыт применения препарата в дозе 50 мг/кг каждые
12 ч. Из-за плохой биодоступности саквинавир используется только в сочетании с ритонавиром.
Атазанавир (Реатаз™) выпускается в капсулах. В будущем атазанавир перспективен для использования
у детей благодаря однократному приему в сутки и редкому развитию дислипопротеидемии. В настоящее
время доза для детей не одобрена. Проходят I и II фазы клинических испытаний. У некоторых больных
развивается желтуха.
Ингибиторы слияния — это новый класс АРВ препаратов. Они подавляют слияние вируса с клеткой. У
взрослых рандомизированные исследования подтвердили эффективность энфувиртида (первого препарата этой класса) в резервных схемах АРТ.
Энфувиртид (Фузеон™) можно назначать детям старше 6 лет. Препарат вводится подкожно в дозе 2
мг/кг каждые 12 ч. В исследовании у 14 детей побочных эффектов не было, но через 2 года только 6 из
14 детей продолжали получать энфувиртид (Church, 2004). Причинами отмены препарата были отказ от
инъекций, местные реакции, неэффективное подавление вирусной нагрузки, тромбоцитопения и отеки.
Контролируемые исследования энфувиртида у детей не проводились.
Антиретровирусную терапию могут осложнить многочисленные лекарственные взаимодействия с другими препаратами. В особенности — с препаратами для лечения туберкулеза и инфекций, вызванных атипичными микобактериями. Поэтому необходимо тщательное наблюдение и консультация специалиста.
Хороший ответ на лечение подразумевает постоянное подавление вирусной нагрузки до не определяемого уровня. Не у всех детей удается достичь полного подавления репликации вируса, и нередко под давлением иммунного ответа и АРТ развивается устойчивость к препаратам. Общепринятого определения
неэффективности антиретровирусной терапии у детей не существует. Поэтому четких показаний к замене схемы АРТ не установлено. Сейчас проходит исследование PENPACT 1, в котором детей разделили
на группы для замены схемы лечения при низкой или высокой вирусной нагрузке (>1000 и >30 000 мл-1
соответственно). Кроме того, критерием неэффективности терапии может быть снижение числа лимфоцитов CD4, например снижение абсолютного числа лимфоцитов CD4 не менее чем на 30% менее чем за
6 мес. У детей с относительно низким числом лимфоцитов CD4 (менее 15%), о неэффективности терапии
может уже свидетельствовать снижение более чем на 5%. Клинические критерии, например токсичность
препаратов, прогрессирование болезни по классификации CDC, повышение восприимчивости к инфекциям, энцефалопатия или задержка физического развития, также могут указывать на неэффективность
лечения.
Самая частая причина неэффективности лечения — недостаточное соблюдение назначений, которое
можно обнаружить у 25-30% детей. Оценка соблюдаемости может быть затруднена, так как опросники
не всегда применимы. Определение уровней препаратов в плазме и исследование на лекарственную устойчивость (например, повторное выявление дикого штамма вируса) также могут использоваться для
оценки соблюдаемости назначений и более эффективного контроля АРТ.
Четких данных о том, когда и как следует менять АРТ у детей, нет. Степень подавления вирусной нагрузки, которой можно достичь с помощью второй и третьей схем терапии, зависит от предшествующей
терапии и характера устойчивости. Чем дольше и интенсивнее была предшествующая АРТ, тем меньшего снижения вирусной нагрузки можно ожидать. При введении новой комбинации АРВ препаратов нужно учитывать возраст ребенка, доступность необходимых лекарственных форм (например, раствора для
грудных детей) побочные эффекты и лекарственные взаимодействия с другими препаратами. В настоящее время не ясно, можно ли ослабить дислипопротеидемию путем замены схемы с ИП на схему с
ННИОТ (McComsey, 2003). У взрослых рандомизированные и проспективные исследования показали,
что замена АРТ по результатам исследования на устойчивость дает лучшие результаты. У детей по этому
вопросу проведено небольшое проспективное исследование (Englund, 2004).
Обычно начальная схема терапии содержит два НИОТ (например зидовудин и ламивудин). При замене
терапии кажется целесообразным ввести в схему два других НИОТ и препарат из нового класса. Мега-ВААРТ, включающая 5 или 6 АРВ препаратов, у детей подробно не изучалась. В отдельных случаях
назначение пяти препаратов может принести пользу, если терапия разными тройными схемами была неэффективной.
Во многом ВИЧ-инфекция у детей отличается от ВИЧ-инфекции у взрослых. Растущий организм, особая динамика вирусной нагрузки и незрелость иммунной системы у детей делают ответ на ВИЧ не таким как у взрослых. Это имеет важное значение для диагностики и лечения ВИЧ-инфекции у детей. Цель лечения — достичь максимального эффекта и избежать долгосрочных побочных эффектов. Для достижения стабильного успеха в лечении ВИЧ-инфекции у детей нужны:
В развитых странах клиническая картина ВИЧ-инфекции у детей изменилась: смертельное заболевание стало хроническим и поддающимся лечению. В развивающихся странах картина совсем другая: большинство детей не имеют доступа к ВААРТ. По данным ВОЗ от ВИЧ-инфекции и ее осложнений в 2004 г. умерли 500 000 детей.
Источник: www.eurasiahealth.org