Вирусная нагрузка показывает, сколько ВИЧ содержится в крови. Наряду с числом лимфоцитов CD4, вирусная нагрузка стала важнейшим косвенным показателем активности ВИЧ-инфекции (Hughes, 1997; Mellors, 1997; Lyles, 2000; Ghani, 2001). Она позволяет оценивать риск прогрессирования болезни и судить о необходимости антиретровирусной терапии а, кроме того, служит важнейшим критерием успеха лечения. Раньше с этой целью использовали другие косвенные показатели — p24, неоптерин или 2- микроглобулин. Сегодня эти методы устарели. Во время тестов на вирусную нагрузку определяют концентрацию вирусной РНК (генетического материала ВИЧ), которая в точности соответствует концентрации самого вируса. Единицей измерения служит число копий вирусной РНК в 1 мл (мл-1). Изменение вирусной нагрузки обозначают как N log10, где N — это степень, в которую возводится 10.
| Вирусная нагрузка, мл-1 | log10 |
| 10 | 1,0 |
| 50 | 1,7 |
| 100 | 2,0 |
| 500 | 2,7 |
| 1000 | 3,0 |
| 10 000 | 4,0 |
| 50 000 | 4,7 |
| 100 000 | 5,0 |
| 1 000 000 | 6,0 |
Чем больше вирусная нагрузка, тем выше риск сокращения числа лимфоцитов CD4 и, следовательно,
прогрессирования ВИЧ-инфекции и возникновения СПИД-индикаторных заболеваний (Mellors, 1997;
Lyles, 2000, Phillips, 2004). Высокой считается вирусная нагрузка свыше 100 000 мл-1 или 5,0 log10 (иногда даже выше 50 000 мл-1), низкой — ниже 10 000 мл-1. Однако, это только ориентировочные значения.
На состояние иммунной системы вирусная нагрузка влияет по-разному. У одних больных число лимфоцитов CD4 достаточно долго не меняется, несмотря на высокую вирусную нагрузку, а у других оно быстро сокращается даже при относительно невысокой вирусной нагрузке. По-видимому, вирусная нагрузка у женщин в целом ниже, чем у мужчин. По данным метаанализа, различие между мужчинами и женщинами составило 41% или 0,23 log10 (95% доверительный интервал 0,16–0,31 log10) (Napravnik, 2002).
Причины этих различий непонятны. Должны ли они учитываться при определении показаний к лечению,
до сих пор не ясно.
Сегодня используют три метода определения вирусной нагрузки: транскрипционную полимеразную
цепную реакцию (ПЦР); метод разветвленной ДНК; метод программного НК-анализа (амплификация
нуклеиновых кислот, NASBA). Они различаются как порогом чувствительности, так и диапазоном, в
пределах которого данные надежны и воспроизводимы (табл. 11.1). Чтобы определить вирусную нагрузку любым из этих методов, имеющееся число копий вирусной РНК необходимо увеличить — амплифицировать. При ПЦР и программном НК-анализе вирусная РНК проходит несколько этапов ферментации,
а затем амплифицируется до измеримого количества. Метод разветвленной ДНК не требует предварительно расщеплять вирусную РНК, при нем после соединения молекулы разветвленной ДНК с участками
вирусной РНК происходит амплификация биологического сигнала.
Вариабельность результатов в пределах каждого из трех методов невелика, так что их данные можно
считать воспроизводимыми, но при интерпретации результатов помнить о ней следует. Изменение вирусной нагрузки менее 0,5 log10 не считают значимым. К примеру, сокращение вирусной нагрузки с
4,3 log10 до 3,9 log10 (то есть с 20 000 до 8 000 мл-1) не всегда говорит о том, что она действительно сократилась. То же самое справедливо и для повышения показателя. Таким образом, часто ни о чем не говорят
изменения вирусной нагрузки в целых 3 раза! Это очень важно объяснить пациентам, чтобы избавить их
от необоснованных огорчений или радости после ознакомления с результатами анализов.
Между тремя методами определения вирусной нагрузки различия существенны (Coste, 1996), так что
пользоваться то одним методом, то другим не следует. Обычно данные, полученные методом разветвленной ДНК, в 2 раза меньше, чем результаты ПЦР. Кроме того, методы отличаются чувствительностью
к разным подтипам вируса (Parekh, 1999). Особого внимания требует обследование пациентов из Африки
и Азии, где часто встречается ВИЧ не подтипа B — у них при первом обращении вирусная нагрузка часто оказывается неожиданно низкой. В таких случаях сменить метод исследования как раз необходимо.
Новые диагностические наборы с усовершенствованными праймерами, вероятно, более чувствительны к
редким подтипам ВИЧ. Каждый метод исследования обладает диапазоном чувствительности, результаты
за пределами которого ненадежны. ПЦР существует в двух вариантах — обычном и сверхчувствительном. У сверхчувствительной ПЦР верхняя граница диапазона чувствительности — 75 000 мл-1, так что
этот метод следует использовать только при предположительно низкой вирусной нагрузке.
Важно следовать правилу: определять вирусную нагрузку всегда одним и тем же методом в одной и той
же лаборатории! Лаборатория должна иметь опыт в проведении этих исследований и постоянно выполнять их в достаточном количестве. Анализ должен быть проведен как можно скорее после забора крови.
Кроме того, в лаборатории должны правильно собирать и транспортировать центрифугированную плазму (все эти тонкости следует предварительно выяснить в самой лаборатории).
Таблица 11.1. Методы определения вирусной нагрузки. На каждом бланке с результатом исследования должны указываться сведения для врача: метод исследования, название и версия диагностического набора, диапазон и порог
чувствительности
| Компания | Roche/Abbott | Bayer/Chiron | Organon |
| Метод | ПЦР | Метод разветвленной ДНК | Nuclisens, количественная проба на ВИЧ-1 |
| Диапазон чувствительности | 400–750 000 мл-1 сверхчувствительный: 50– 75 000 мл-1 | 100 000–500 000 мл-1 | 40–10 000 000 мл-1 |
| Сопоставимость | Результат примерно в 2 раза выше получаемого методом разветвленной ДНК (диагностические наборы 2,0 и 3,0) | Результат примерно в 2 раза ниже получаемого при ПЦР (диагностические наборы 2,0 и 3,0) | Результат примерно соответствует результатам ПЦР |
| Преимущества метода | Частота ложноположительных результатов ниже, чем у метода разветвленной ДНК | Одинаково чувствителен ко всем подтипам ВИЧ (A-G), относительно прост в исполнении | Одинаково чувствителен ко всем подтипам ВИЧ (A-G), большой диапазон чувствительности |
На величину вирусной нагрузки влияют не только особенности метода, но и множество других факторов.
В частности, она меняется после вакцинации и на фоне сопутствующих инфекций. Особенно высокой
вирусная нагрузка бывает при острой оппортунистической инфекции. По данным одного исследования,
активный туберкулез способен повысить вирусную нагрузку в 5–160 раз (Goletti, 1996). Значительного
повышения вирусной нагрузки можно ожидать и при сифилисе (Buchacz, 2004). В такое время определять ее нет смысла. После введения вакцины — против гриппа (O’Brien, 1995) или пневмококковой
(Farber, 1996) — наблюдается преходящее повышение вирусной нагрузки (Kolber, 2002). Наиболее высокой она становится через 1–3 недели после вакцинации, поэтому контрольное исследование необходимо
назначать не раньше, чем через 4 недели.
Следует отметить, что повышение вирусной нагрузки не всегда говорит о вирусологической неудаче лечения и лекарственной устойчивости. Так называемые скачки вирусной нагрузки (временные незначительные повышения) обычно проходят без последствий — это подтверждено многочисленными исследованиями последних лет (см. раздел «Цели и принципы лечения»). Кроме того, всегда следует помнить о
том, что пробы крови могли быть перепутаны — людям свойственно ошибаться.
Определение вирусной нагрузки, введенное в практику в 1996–1997 годах, полностью изменило подходы
к лечению ВИЧ-инфекции. Передовые исследования группы под руководством Дэвида Хо (David Ho)
показали, как развивается ВИЧ-инфекция in vivo (Ho, 1995; Perelson, 1996). Изменение вирусной нагрузки на фоне антиретровирусной терапии чутко реагирует на репродукцию и элиминацию вируса в организме. Уже через две недели после начала ВААРТ концентрация ВИЧ-1 в плазме сокращается на 99%
(Perelson, 1997). По данным одного крупного когортного исследования, через 4 недели лечения у 84%
больных вирусная нагрузка стала ниже 1,000 мл-1. Сокращение вирусной нагрузки происходит в два этапа: в первые 3–6 недель чрезвычайно стремительно, а затем —на протяжении долгого времени — медленно (Wu, 1999).
Чем выше была вирусная нагрузка перед началом терапии, тем дольше она остается определимой. По
данным одного исследования, вирусная нагрузка 1000 мл-1 падает до неопределимого уровня через 15
дней, а 1000 000 мл-1 — через 113 дней (Rizzardi, 2000). График на рис. 11.1 демонстрирует типичную
двухэтапную динамику сокращения исходно высокой (в данном случае почти 4 000 000 мл-1) вирусной
нагрузки.
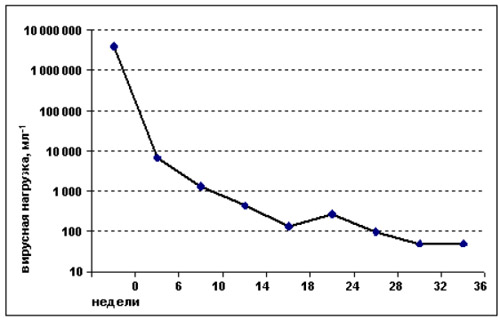
Рисунок 11.1. Характерная двухэтапная динамика вирусной нагрузки на фоне ВААРТ. Исходно вирусная нагрузка была
чрезвычайно высокой, ниже 50 мл-1 она стала лишь к 32-й неделе лечения. Обратите внимание на временный подъем
вирусной нагрузки на 24-й неделе. Возможно, он обусловлен вариабельностью метода. Больной получал одну и ту же
схему ВААРТ.
Множество исследований пыталось установить, можно ли прогнозировать успех лечения в самом его начале (Demeter, 2001; Kitchen, 2001; Lepri, 2001; Thiabut, 2000). По данным исследования среди 124 пациентов, снижение вирусной нагрузки менее чем 0,72 log10 за первую неделю терапии послужило прогностическим фактором неудачи лечения у более 99% пациентов (Polis, 2001). Для клинической практики,
однако, это вряд ли имеет значение — по нашему опыту, определять вирусную нагрузку в первые две
недели после начала лечения бессмысленно.
Первые месяцы мы обычно определяем вирусную нагрузку раз в 4 недели до тех пор, пока она не станет
неопределимой — в этом основная цель лечения! Затем исследование достаточно повторять раз в 3 месяца. При повторном повышении вирусной нагрузки исследования вновь необходимо проводить чаще.
Через месяц после начала ВААРТ вирусная нагрузка должна стать меньше 5 000 мл-1. Если этого не произошло, вероятность вирусологической неудачи лечения высока (Maggiolo, 2000).
Определять вирусную нагрузку не в крови и плазме, а в других биологических жидкостях (спинномозговой жидкости, влагалищном отделяемом, сперме) тоже можно — результаты вполне надежны. Тем не
менее, такие исследования чаще проводят в научных целях, а на практике используют редко.
Источник: www.eurasiahealth.org