»
Главная
»
Митохондриальная токсичность аналогов нуклеозидов
Через два года после введения ингибиторов протеазы в арсенал антивирусной терапии стали появляться сообщения о заметных нарушениях метаболизма и изменении внешности у ВИЧ-инфицированных. Эти «метаболические» симптомы объединили под общим названием «липодистрофия» (Carr, 1998). Сегодня, спустя 9 лет после появления высокоактивной антиретровирусной терапии (ВААРТ), накапливается все больше сведений о том, что липодистрофический синдром является результатом перекрывающихся эффектов различных препаратов, входящих в схемы ВААРТ. Главный механизм в патогенезе метаболических нарушений и повреждений различных органов под влиянием аналогов нуклеозидов — это митохондриальная токсичность (Brinkman, 1999).
Нуклеозидные ингибиторы обратной транскриптазы (НИОТ) представляют собой пролекарства, т.е. неактивную форму препарата (Kakuda, 2000), поскольку ингибировать активность фермента–мишени —
обратной транскриптазы ВИЧ — они способны только после перехода в активную форму путем внутриклеточного фосфорилирования. НИОТ–трифосфаты не только нарушают механизмы репликации ВИЧ,
но и подавляют также полимеразу человека, так называемую «гамма–полимеразу», необходимую для репликации митохондриальной ДНК (мтДНК). Подавление этими препаратами гамма–полимеразы приводит к снижению концентрации мтДНК — небольшой кольцевой молекулы, многочисленные копии которой в норме содержатся в каждой митохондрии и в сотнях копий в каждой клетке человеческого организма. Единственное биологическое предназначение мтДНК — кодирование субъединиц ферментов дыхательной цепи, располагающихся на внутренней мембране митохондрий. Таким образом, снижая концентрацию мтДНК, НИОТ приводят к нарушению функции дыхательной цепи.
Нормальное функционирование дыхательной цепи — обязательно условие для многих метаболических
процессов. Главная задача дыхательной цепи — синтез АТФ (главного «энергоносителя» клетки) путем
окислительного фосфорилирования. Кроме того, дыхательная цепь обеспечивает утилизацию НАДH и
ФАДH — конечных продуктов окисления жирных кислот. Этим объясняется часто сопутствующее митохондриальной токсичности мелко– и крупнокапельное внутриклеточное отложение триглицеридов.
Наконец, что немаловажно, нормальное функционирование дыхательной цепи необходимо для синтеза
ДНК, поскольку синтез пиримидиновых нуклеозидов de novo происходит при участии фермента, расположенного на внутренней мембране митохондрий, — дигидрооротатдегидрогеназы (ДГОДГ) (Loffler,
1997). Клиническое значение этого факта рассматривается ниже.
В развитии митохондриальной токсичности можно выделить несколько закономерностей (Walker,
2002b):
1. Митохондриальная токсичность зависит от концентрации НИОТ. Высокие концентрации НИОТ сильнее снижают уровень мтДНК, чем низкие. Терапевтические дозы некоторых аналогов нуклеозидов близки к нижней границе доз, токсичных для митохондрий.
2. Митохондриальная токсичность развивается медленно. Изменения метаболизма митохондрий наблюдаются только в том случае, когда уровень мтДНК снижается до определенного порога, что возможно
только при длительном лечении НИОТ. В связи с этим в первые месяцы ВААРТ митохондриальная токсичность обычно не проявляется. Кроме того, длительное лечение НИОТ может привести к повреждению митохондрий даже при относительно низких концентрациях НИОТ.
3. У разных аналогов нуклеозидов и нуклеотидов способность взаимодействовать с гамма–полимеразой
существенно различается. В порядке убывания ингибирующего действия на гамма-полимеразу своих активных метаболитов НИОТ располагаются так: зальцитабин (ХивидTM) > диданозин (ВидексTM) > ставудин (ЗеритTM) > ламивудин (ЭпивирTM) > абакавир (ЗиагенTM) = тенофовир (ВиридTM).
4. Особенность зидовудина в том, что его активная форма — трифосфат — является лишь слабым ингибитором гамма-полимеразы. Однако этот препарат обладает другими механизмами митохондриальной
токсичности. Недавно было показано, что в организме зидовудин без участия ферментов может превращаться в ставудин, по крайней мере в некоторых клетках (Becher, 2003; Bonora, 2004). Возможно этим
объясняется тот факт, что в ряде исследований описано снижение концентрации мтДНК при лечении зидовудином.
5. Митохондриальная токсичность тканеспецифична. Это объясняется тем, что захват неактивной формы
НИОТ клетками и их митохондриями, а также фосфорилирование с переходом препарата в активную
форму в разных типах клеток различается.
6. При комбинировании двух и более НИОТ в их токсическом действии на митохондрии возможен кумулятивный эффект и синергизм.
Снижение уровня мтДНК клинически может проявляться поражением одного или нескольких органов-мишеней (рис. 1).
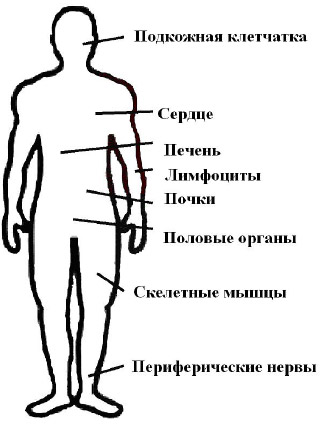
Рисунок 1. Органы, в которых проявляется митохондриальная токсичность.
В печени митохондриальная токсичность сопровождается повышенным отложением липидов, что приводит к мелко- или крупнокапельной жировой дистрофии печени. Иногда этому сопутствует повышение
активности аминотрансфераз. В этом случае жировая дистрофия печени может прогрессировать с развитием печеночной недостаточности и лактацидоза — угрожающему жизни, но, к счастью, редкому осложнению. Впервые жировая дистрофия печени и лактацидоз были описаны в начале 90-х гг. у больных,
получавших монотерапию диданозином (Lambert, 1990); сегодня печеночная митохондриальная токсичность наблюдается при лечении любыми НИОТ, оказывающими относительно сильное ингибирующее
действие на гамма-полимеразу, — особенно так называемыми «Д-препаратами»: зидовудином (ВидексTM), ставудином (ЗеритTM) и зальцитабином (ХивидTM). Показано, что каждый из Д-препаратов у
ВИЧ-инфицированных приводит к время-зависимому снижению уровня мтДНК в гепатоцитах. При
электронной микроскопии обнаруживаются морфологические изменения митохондрий.
Типичное осложнение митохондриальной токсичности — повышение сывороточного уровня лактата.
Гиперлактатемия чаще описывалась при длительном лечении ставудином (Saint Marc, 1999; Carr, 2000),
особенно в комбинации с диданозином. Токсичность диданозина также повышается в результате взаимодействий с рибавирином и гидроксимочевиной. Значение бессимптомной гиперлактатемии не ясно. Если
повышение уровней лактата проявляется клинически, симптомы часто бывают неспецифичными — тошнота, болезненность в правом подреберье, миалгия. В большинстве случаев уровни бикарбоната и анионный интервал (Na+ [HCO3 + Cl]) в норме, но активность печеночных аминотрансфераз в большинстве
случаев слегка повышена (Lonergan, 2000a). Поэтому в диагностике приходится полагаться на более трудоемкое определение сывороточного уровня лактата. Чтобы избежать ошибок, венозную кровь следует
брать в покое, без наложения жгута. Кровь следует собирать во фторированные пробирки, помещать на
лед и сразу доставлять в лабораторию для незамедлительного исследования. В дифференциальной диагностике следует учитывать, что причиной лактацидоза могут быть не только повреждение митохондрий
(табл. 1); следует исключать повреждение различных органов.
Таблица 1. Причины гиперлактатемии и лактацидоза
| Лактацидоз типа A | Лактацидоз типа B |
| (Тканевая гипоксия) | (Другие механизмы) |
| Шок | Дефицит тиамина |
| Отравление окисью углерода | Алкалоз (pH>7,6) |
| Сердечная недостаточность | Эпилепсия |
| Адреналин (ятрогенный, эндогенный) | |
| Печеночная недостаточность | |
| Новообразования (лимфома, солидные опухоли) | |
| Интоксикации (нитропруссид, метанол, этиленгликоль, салицилаты) | |
| Фруктоза | |
| Редкие ферментопатии | |
| Мутации мтДНК | |
| Снижение уровня мтДНК |
Митохондриальная миопатия у ВИЧ-инфицированных, получающих антиретровирусные препараты,
впервые была описана при лечении высокими дозами зидовудина (Arnaudo, 1991). Слабость скелетных
мышц может проявляться при динамической или статической нагрузке. Сывороточный уровень КФК
часто бывает в норме или немного повышен. Гистологическое исследование биоптатов мышц позволяет
отличить эту форму митохондриальной токсичности от ВИЧ-миопатии, которая может развиться одновременно. При митохондриальной миопатии при гистохимическом исследовании мышечных волокон
цитохром-c-оксидаза нередко не обнаруживается и выявляются ультраструктурные аномалии митохондрий, а при ВИЧ-миопатии обычно обнаруживается инфильтрация T-лимфоцитами CD8. Исследование
при нагрузке позволяет обнаружить низкий лактатный порог и снижение элиминации лактата, однако в
клинической практике эти изменения трудно отличить от плохой переносимости аэробной нагрузки
(детренированности).
Длительное лечение Д-препаратами также нередко приводит к полинейропатии нижних конечностей
(преимущественно симметричной, сенсорной и дистальной) (Simpson, 1995; Moyle, 1998). Повышенный
уровень лактата в сыворотке помогает отличить этот вид аксональной нейропатии от его ВИЧ-варианта с
такими же клиническими проявлениями. В дифференциальной диагностике помогает также тот факт, что
митохондриальная токсичность развивается в большинстве случаев через несколько недель и месяцев
после начала лечения Д-препаратами. Напротив, ВИЧ-полинейропатия обычно не прогрессирует и порой
даже ослабевает на фоне длительной антиретровирусной терапии.
В узком понимании термин «липодистрофия» применяется для описания перераспределения жировой
ткани. У некоторых больных липодистрофия проявляется избыточным накоплением жира в определенных местах (обычно на животе и тыльной стороне шеи), а у других — напротив, уменьшением жировой
ткани (на щеках, височной области, подкожной клетчатке конечностей). В некоторых случаях избыточное отложение жира в одних местах сочетается с уменьшением жировой ткани в других. Уменьшение
жировой ткани (липоатрофия) частично обратимо и обычно становится заметным спустя год или более
после начала антиретровирусной терапии. В пораженной жировой клетчатке выявляются ультраструктурные изменения митохондрий и сниженное содержание мтДНК, в особенности у больных, получавших
ставудин (Walker, 2002a). Исследования жировых клеток in vitro и in vivo показали сниженное содержание липидов в клетках, уменьшение факторов адипогенной транскрипции (PPAR-гамма и SREBP-1) и
повышение индексов апоптоза. НИОТ могут также нарушать некоторые эндокринные функции липоцитов. Например, они способны нарушать секрецию адипонектина и тем самым способствовать развитию
инсулинорезистентности. Наибольший риск несет ставудин, однако и другие НИОТ, например, зидовудин, тоже могут оказывать такое действие. Если ставудин заменить другим НИОТ, уровни мтДНК и индексы апоптоза улучшаются, так же как отмечается объективное, хотя и небольшое, увеличение жировой
ткани (McComsey, 2004a). Замена ингибиторов протеазы не приводит к уменьшению липоатрофии и
апоптоза адипоцитов. Все эти факты указывают на доминирующий эффект митохондриальной токсичности в патогенезе липоатрофии.
В ряде исследований показано влияние НИОТ на уровни мтДНК в крови (Cote, 2003; Miro, 2003). Функ-
циональные последствия митохондриальной токсичности для лимфоцитов пока не известны. В данном
случае важно заметить, что при повышении уровней диданозина в плазме (на фоне тенофовира или у
больных с низким весом) было отмечено отсроченное снижение числа лимфоцитов CD4 и CD8 (Negredo,
2004). Недавние исследования стимулированных митогенами T-лимфоцитов in vitro показали, что диданозин в концентрации, немного превышающей терапевтическую, вызывал значительное снижение уровня мтДНК и последующее отсроченное снижение пролиферации лимфоцитов и усиление апоптоза (Setzer,
2005a; Setzer, 2005b). Таким образом, митохондриальная токсичность — наиболее вероятное объяснение позднего снижения числа лимфоцитов при лечении диданозином. Данные показывают, что митохондриальная токсичность НИОТ для лимфоцитов оказывает иммуносупрессорное действие.
В редких случаях на фоне ВААРТ встречается бессимптомное повышение активности сывороточной липазы, однако прогностического значения в отношении развития панкреатита оно не имеет (Maxson,
1992). В целом частота панкреатита оценивается в 0,8 случаев на 100 лет ВААРТ схемами на основе
НИОТ. Клинически выраженный панкреатит чаще развивается при лечении диданозином. Повторное назначение диданозина может спровоцировать рецидив панкреатита, поэтому противопоказано. Высказаны
предположения, что причиной панкреатита служит митохондриальная токсичность, но пока доказательств этому не найдено.
В новых исследованиях изучается безопасность зидовудина в профилактике вертикальной передачи
ВИЧ. В исследовании у беременных обезьян, получавших комбинацию зидовудина с ламивудином в течение 10 недель до родов, зидовудин был обнаружен в мтДНК. Кроме того, лечение комбинацией НИОТ
привело к снижению уровня мтДНК в скелетных мышцах, сердце и головном мозге (Gerschenson, 2004).
Обнаружена повышенная частота митохондриальных симптомов у детей, рожденных женщинами, получавшими НИОТ во время беременности (Blanche, 1999). Нередко обнаруживается гиперлактатемия, иногда она сохраняется в течение нескольких месяцев после рождения (Noguera, 2003). Очень низкие уровни
мтДНК обнаружены в плаценте, а также в пуповинной крови новорожденных (Shiramizu, 2003). Другие
клинические исследования не выявили повышенного риска при перинатальной профилактике зидовудином, однако ключевые параметры митохондриальной дисфункции в них не оценивались. Необходимо
срочно провести анализ отдаленных данных. На сегодняшний день нет сведений, которые бы требовали
пересмотра текущей тактики использования зидовудина для профилактики вертикальной передачи ВИЧ.
Значение митохондриальной токсичности для почек спорно. Нуклеотидный ингибитор обратной транскриптазы тенофовир (ВиридTM) в дозах, превышавших терапевтические, вызывает у животных синдром
Фанкони со снижением реабсорбции фосфата в почечных канальцах и остеомаляцией (обзор тенофовира,
2001). Реабсорбция тенофовира в почечных канальцах происходит с участием особого анионного переносчика; не исключено, что очень высокая концентрация препарата в клетке может привести к клинически выраженному ингибированию и снижению концентрации мтДНК несмотря на то, что активность тенофовира в повреждении репликации мтДНК низкая. Хотя описано несколько случаев снижения реабсорбции фосфатов почками при лечении тенофовиром, следует заметить, что ни в предварительных клинических испытаниях тенофовира, ни в последующих клинических обзорах не обнаружено митохондриальной токсичности тенофовира для почечных канальцев.
Источник: www.eurasiahealth.org