Процесс проникновения ВИЧ в клетку-мишень, то есть в лимфоцит CD4, состоит из трех основных этапов:
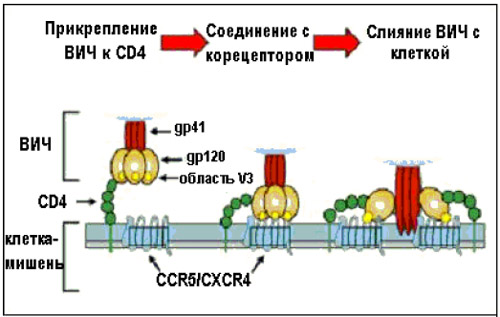
Рисунок 3.1. Три основных этапа проникновения ВИЧ в клетку (Источник: Moore J. P., Doms R.W. The entry of entry inhibitors:
a fusion of science and medicine. PNAS, 2003, 100:10598-602).
Теоретически, на каждый этап проникновения можно воздействовать и заблокировать его. Существующие на сегодня три класса лекарственных средств — ингибиторы прикрепления, блокаторы корецепторов и ингибиторы слияния — объединены в группу ингибиторов проникновения. В 2003 году в Европе и
США был лицензирован первый препарат этой группы — энфувиртид (T-20). Работа над многочисленными новыми ингибиторами проникновения уже вышла на финишную прямую, хотя в ближайшие два
года на рынке они не появятся. Подробнее об этом рассказывается в главе о перспективах ВААРТ на
2005–2006 годы.
Энфувиртид (T-20, Фузеон®) — прообраз ингибиторов слияния. Это относительно крупный пептид из
36 аминокислот, и поэтому его необходимо вводить подкожно, как инсулин. Он связывается с промежуточной структурой белка внешней оболочки ВИЧ — gp41, который появляется на поверхности вируса,
когда он сливается с мембраной клетки-мишени. В 2003 году энфувиртид был лицензирован в Европе и
США в качестве средства лечения ВИЧ-инфекции у принимавших ранее антиретровирусные средства
взрослых и детей старше 6 лет. Назначать его до сих пор желательно в рамках клинических испытаний,
чтобы и дальше накапливать клинический опыт применения этого нового средства.
В одном из первых испытаний ВИЧ-инфицированным проводили монотерапию энфувиртидом внутривенно. Эффект терапии оказался дозозависимым, а в группе получавших его в максимальной дозе 100 мг
2 раза в стуки вирусная нагрузка в среднем сократилась почти на 2 log10 (в 100 раз) (Kilby, 1998). Первое
исследование, в котором энфувиртид вводили подкожно, тоже показало, что он обладает положительным
дозозависимым эффектом. В нем участвовали 78 пациентов с весьма богатым анамнезом антиретровирусной терапии, а подкожное введение препарата осуществлялось либо с помощью носимого дозатора
(такого же, как для введения инсулина), либо путем обычных подкожных инъекций 2 раза в сутки (Kilby,
2002). Тем не менее, эффективность терапии оказалась ниже, чем при внутривенном введении препарата:
вирусная нагрузка сокращалась самое большее на 1,6 log10 (примерно в 40 раз). В исследовании T20-205
70 пациентам, большинство из которых ранее получали ИП, энфувиртид вводили подкожно по 50 мг 2
раза в сутки в течение 48 недель (Lalezari, 2000). По истечении этого срока вирусологический эффект сохранялся у трети пациентов, однако стало очевидно, что больше пользы энфувиртид приносил тем больным, которые получали и другие новые антиретровирусные средства по схеме ВААРТ. Первое исследование II фазы (T20-206) окончательно доказало, что добавление энфувиртида в качестве «монотерапии»
особого эффекта не дает (Lalezari, 2002). Примерно у двух третей участников данного исследования наблюдались ограниченные реакции в месте инъекции (по большей части легкие). В остальном энфувиртид
в целом переносился хорошо.
Наконец, данные двух исследований III фазы позволили лицензировать энфувиртид. Исследование
TORO 1 («Сопоставление простого обновления схемы ВААРТ с включением в нее энфувиртида») проводилось в Северной Америке и Бразилии. В него был включен 491 пациент с очень богатым анамнезом
антиретровирусной терапии, причем у большинства ВИЧ обладал множественной лекарственной устойчивостью. В исследовании TORO 2 приняли участие 504 пациента из Европы и Австралии. В обоих исследованиях пациентам усовершенствовали схему ВААРТ и либо вводили в нее энфувиртид (90 мг 2 раза
в сутки, п/к), либо нет (Lalezari, 2003; Lazzarin, 2003). В исследовании TORO-1 сокращение вирусной нагрузки на фоне применения энфувиртида было больше на 0,94 log10 (в 8,7 раз), в исследовании TORO-2 — на 0,78 log10 (в 6 раз). Вирусологический эффект сохранялся спустя 96 недель (Arasteh, 2004).
Следить за эффектом энфувиртида необходимо с самого начала его применения — этого прежде всего
требует его высокая цена. Если за 8–12 недель лечения этим средством вирусная нагрузка не снизится
хотя бы на 1 log10 (в 10 раз), большей пользы от него ожидать не следует и можно избавить пациента от
необходимости делать подкожные инъекции дважды в сутки. Вводить двойную дозу энфувиртида 1 раз в
сутки тоже не рекомендуется. Хотя доза 180 мг 1 раз в сутки биологически эквивалентна стандартной
дозе 90 мг 2 раза в сутки (по AUC), недавно была обнаружена тенденция к менее выраженному сокращению вирусной нагрузки при введении энфувиртида в дозе 180 мг 1 раз в сутки. Безусловно, это свидетельствует о более низкой минимальной сывороточной концентрации энфувиртида при его использовании в таком режиме (Thompson, 2004).
Открытиями исследований TORO-1 и TORO-2 стало то, что на фоне применения энфувиртида возрастает
частота лимфаденопатии и бактериальной пневмонии (она составляла 4,9:100 в год среди получавших
энфувиртид и только 0,6:100 в год среди тех, кто его не получал) (Lalezari, 2003). Кроме того, несколько
чаще у получавших энфувиртид отмечался сепсис, но в этом случае разница не была статистически значимой. Причина учащения инфекционных осложнений осталась невыясненной, хотя подозревают, что
она кроется в способности энфувиртида связываться с гранулоцитами.
Мутации устойчивости к энфувиртиду возникают относительно быстро, но судя по всему, они снижают
биологическую приспособляемость ВИЧ (Lu, 2002). Сродство к энфувиртиду рецепторов ВИЧ, повидимому, не столь значительно, как полагали изначально. В исследованиях TORO-1 и TORO-2 было
установлено, что причиной сниженной чувствительности к энфувиртиду служит короткая последовательность gp41, для формирования которой достаточно всего одной точечной мутации. С другой стороны, устойчивые к классическим препаратам ВААРТ (НИОТ, ННИОТ, ИП) вирусы к энфувиртиду оказываются чувствительными (Greenberg, 2003). Будучи крупным пептидом, энфувиртид вызывает продукцию антител. Однако его эффективность от этого, по всей видимости, не падает (Walmsley, 2003).
Подведем итог. Больным со стабильно низкой вирусной нагрузкой и тем, у кого возможности «классической» ВААРТ не исчерпаны, назначать энфувиртид не следует. В резервной же терапии, напротив, этот
препарат представляется весьма перспективным. Результаты испытаний энфувиртида с оценкой клинических исходов пока отсутствуют, но ожидать от него клинического успеха вполне логично. Математический анализ данных исследований TORO-1 и TORO-2 показал, что увеличение продолжительности
жизни при добавлении энфувиртида к обновленной схеме ВААРТ больше, чем при простом обновлении
схемы ВААРТ, на 1,5 года (Hornberger, 2003). По-прежнему беспокойство вызывает высокая цена энфувиртида: с его введением в схему ВААРТ стоимость лечения возрастает вдвое. Компания-производитель
утверждает, что энфувиртид — одно из самых сложных лекарственных средств, которые она когда-либо
выпускала. Ситуация вряд ли изменится и с появлением разрабатываемого сегодня усовершенствованного препарата — ПЭГ-энфувиртида, который можно будет принимать раз в неделю.
Это весьма разнородная группа препаратов, и рассказывать о ней как о чем-то едином невозможно. Попытки воздействовать на растворимые молекулы CD4, чтобы предотвратить прикрепление ВИЧ к лимфоцитам CD4, неоднократно предпринимались с начала 1990-х гг. (Daar, 1990; Schooley, 1990). Скольнибудь обнадеживающих результатов они не принесли, и несколько лет о них не вспоминали вовсе. Тем
временем знания о механизме проникновения ВИЧ в клетку пополнялись, и после успешных испытаний
первого ингибитора проникновения — энфувиртида — работа над ингибиторами прикрепления закипела
с новой силой. Пока большинство из них находится в лишь на начальной стадии разработки, а фармакокинетические показатели зачастую оставляют желать лучшего, так что в основном речь идет об экспериментальных средствах. Как правило, мишенью для ингибиторов прикрепления служит взаимодействие
гликопротеида gp120 с рецептором CD4. В отличие от блокаторов корецепторов (см. ниже), активность
ингибиторов прикрепления от тропности корецепторов не зависит (Trkola, 1998).
Pro-542 (рекомбинантный CD4-IgG2) представляет собой растворимый антителоподобный четырехвалентный химерный белок, разработанный компанией Progenics. Связываясь с гликопротеидом gp120,
Pro-542 не позволяет ВИЧ прикрепиться к рецептору CD4 лимфоцита. По данным клинических испытаний I фазы, препарат обладает хорошей переносимостью, и даже единственная его в/в инфузия в дозе
10 мг/кг приводит к сокращению вирусной нагрузки — правда, минимальному (Jacobson, 2000). В недавнем исследовании Pro-542 в более высокой дозе 25 мг/кг (путем в/в инфузии) получали 12 ВИЧ-инфицированных больных (Jacobson, 2004). В среднем вирусная нагрузка сократилась на 0,5 log10 (в 3
раза), эффект сохранялся на протяжении 4–6 недель. Примечательно, что активнее препарат действовал у
больных с более поздними стадиями ВИЧ-инфекции. Чувствительность к Pro-542 X4-тропных (см. ниже)
штаммов вируса была такой же, как и R5-тропных штаммов. Переносилась однократная в/в инфузия хорошо. Кроме того, Pro-542 прошел клинические испытания среди детей (Shearer, 2000). Его высокая эффективность показана в экспериментах на мышах линии SCID (модель тяжелого комбинированного иммунодефицита) (Franti, 2002). Важным недостатком Pro-542 является неудобный путь введения — в/в
инфузия.
BMS-488,043 — один из первых ингибиторов прикрепления компании Bristol-Myers Squibb, который
крайне избирательно и обратимо связывается с вирусным гликопротеидом gp120, предотвращая прикрепление ВИЧ к рецептору CD4. Этот препарат пришел на смену BMS-806. В начале 2004 г. были опубликованы первые результаты применения BMS-488,043 у ВИЧ-инфицированных людей (Hanna, 2004). В
этом клиническом испытании препарат назначали 2 раза в сутки в дозе 800 или 1800 мг, контрольная
группа получала плацебо. Через 7 суток монотерапии в обеих группах BMS-488,043 вирусная нагрузка
сократилась соответственно на 0,72 log10 (в 5 раз) и 0,96 log10 (в 9 раз) в среднем. Более 1 log10 сокращение вирусной нагрузки составило у 7 из 12 пациентов, получавших препарат в дозе 800 мг 2 раза в сутки,
и у 8 из 12 пациентов, которым он был назначен в дозе 1800 мг 2 раза в сутки. Переносился BMS-488,043
хорошо. В то же время, лечение этим препаратом требует приема слишком большого числа таблеток —
этот недостаток требуется срочно исправить.
TNX 355 (ранее Hu5A8) представляет собой моноклональное антитело, которое связывается с рецептором CD4 и тем самым предотвращает проникновение ВИЧ в клетку. В настоящее время его разработкой
занимается компания Tanox Biosystem (Хьюстон, Техас). Механизм действия этого препарата уже подробно описан. В отличие от прочих ингибиторов прикрепления, TNX 355 не мешает гликопротеиду
gp120 связываться с молекулой CD4, а предотвращает прикрепление gp120 к корецепторам CCR5 и
CXCR4. В связи с этим некоторые специалисты относят TNX 355 к блокаторам корецепторов. TNX 355
можно вводить только в/в. Первое клиническое испытание Ia фазы уже завершено. В нем пациентам, ранее получавшим антиретровирусные средства, TNX 355 вводили однократно в разных дозах. У 10 из
12 пациентов отмечено сокращение вирусной нагрузки более 1 log10 (Kuritzkes, 2004). У больных, которые получали препарат в максимальной дозе (25 мг/кг), вирусная нагрузка сократилась в среднем на
1,1 log10 (в 12,5 раз). Пик антиретровирусной активности отмечен через 3 недели после введения препарата. Судя по всему, устойчивость к TNX 355 развивается быстро (Jacobson, 2004). В настоящее время в
США проходят контролируемые испытания TNX 355 среди пациентов с богатым анамнезом антиретровирусной терапии. TNX 355 используется в виде в/в инфузий раз в 2 недели в течение 1 года. Набор участников в исследование продолжается, первых данных следует ждать не раньше конца 2005 г.
Источник: www.eurasiahealth.org